Dentro de unos 10 años, cuando mi hija Paula (ahora tiene 6) acuda a su primera revisión ginecológica, su médico le planteará hacerse unas pruebas para planificar su futura maternidad y no parecerá una locura. Para entonces, cualquier mujer podrá saber, con tiempo de reacción y sobre la base de un informe científico, cuándo es su mejor momento para ser madre. Seguramente se hará un análisis genético de aquellos genes en los que está escrito cuándo ha tenido su primera regla, cuándo le llegará la menopausia y cuáles serán sus mejores años para concebir. De hecho, un extenso estudio publicado en Nature Genetics a finales del octubre pasado demuestra que hay una base biológica para la elección del momento en que tendremos hijos. Hasta ahora, se pensaba que nuestro comportamiento reproductivo estaba relacionado principalmente con la elección personal o las circunstancias sociales y los factores ambientales. “Por primera vez sabemos dónde encontrar las áreas de ADN relacionadas con este hecho vital. Por ejemplo, hemos detectado que las mujeres con variantes de ADN para posponer la maternidad también tienen fragmentos asociados con inicios de la menstruación y la menopausia posteriores. Con estos conocimientos algún día los médicos podrán responder a la pregunta ‘¿Hasta cuándo puedo esperar?’ basándose en nuestros genes”, aseguraba Melinda Mills, una de las autoras del estudio de la Universidad de Oxford. Nuestros genes no determinan nuestro comportamiento, pero por primera vez se ha identificado parte del código de ADN que más influye biológicamente en esta decisión vital. De hecho, entre los genes hallados hay algunos que apuntan directamente a la infertilidad.
Un test de futuro
Otra recomendación que harán a mi hija es que se haga un análisis de telómeros, los indicadores de nuestra edad celular, para ver si su edad real coincide con la biológica. Este tipo de análisis, aunque aún minoritarios, ya son una realidad. En España, la única empresa capacitada para realizarlos es Life Length, cuyo CEO, Stephen J. Matlin explica: “Medimos a nivel celular, cromosoma a cromosoma, decenas de miles de longitudes teloméricas en una muestra de sangre, lo que nos permite determinar cuál es la edad biológica de una persona, que casi nunca coincide con la real. Conforme vamos cumpliendo años esta brecha va aumentando por la mala alimentación, estrés, los contaminantes a los que estamos expuestos, la vida sedentaria, etc. Además, en el campo de la fertilidad, esto se une al retraso en la edad de tener hijos, que en España llega a los 35 años, cuando en los años 70 estaba en los 25. Nuestra medición puede ser muy valiosa para saber el momento biológico real en el que se encuentra cada mujer y qué posibilidades tiene de engendrar de forma natural e incluso del posible éxito de un tratamiento de reproducción asistida”.
Lo último es pedir un ‘cellfie’, esto es, la imagen del embrión en sus primeras horas de vida como recuerdo
Con toda esta información, cualquier mujer podrá saber cuál es su mejor momento para ser madre. Y, si decide posponerlo, podrá congelar óvulos en su estado óptimo para usarlos cuando decida. De hecho, ya hoy en día, la cantidad de mujeres que decide guardar óvulos para el futuro crece cada año. Según datos de IVI (Instituto Valenciano de Infertilidad), por ejemplo, en 2007 solo el 6,7 % de los ovocitos congelados eran para preservación, mientras que en 2015 ya supusieron el 24,3 %. “Solo algunas de ellas tendrán que darles uso en el futuro, pero es como un seguro que te puede evitar disgustos a largo plazo”, dice Matlin.
Mas madres de 45
A pesar de todas estas ventajas, los especialistas insisten en la importancia de concienciar a la población de que, en la medida de lo posible, hay que adelantar la decisión de ser madre. “Tenemos una visión demasiado positiva de las posibilidades de la reproducción asistida y del estado de fertilidad de la mujer a ciertas edades. A menudo recibimos a mujeres de 40 años que piensan que por llevar una vida activa, una alimentación saludable y no fumar no van a tener problema para quedarse embarazadas, y cuando les decimos que tienen baja la reserva ovárica o menopausia precoz nos miran como a bichos raros. Y es que su calidad de vida solo significa que no tienen factores de riesgo extra, pero la edad es la edad y, aunque no tengan un problema de fertilidad concreto, se están acercando al periodo de la vida en el que quedarse embarazada de forma natural es muy complicado”, asegura Rita Vassena, directora científica de la Clínica Eugin. Y continúa: “En nuestra clínica la media de edad de las pacientes ronda los 38 años y muchas no tienen ningún problema aparte de su edad. Por eso, en nuestro departamento de I+D hemos desarrollado una línea de concienciación de la fertilidad. Nos hemos dado cuenta de que los propios ginecólogos hacen mucho hincapié en la anticoncepción y muy poco en cuidar la fertilidad. Y estoy convencida de que muchas mujeres que nos llegan lo hacen por error, porque les ha faltado información primaria”. Una cosa que no nos dicen a menudo es que, además de que la cantidad de óvulos se reduce con los años, también su calidad se resiente. Por eso las células reproductivas de una mujer de 42 años tienen muy pocas posibilidades de engendrar un hijo, incluso con la ayuda de las técnicas modernas de reproducción asistida.
Infertilidad funcional
Según explica Vassena: “Conforme vamos siendo más mayores, nuestros óvulos acumulan errores, por ejemplo, en cómo se distribuyen los cromosomas. Por eso es mucho más improbable que nos quedemos embarazadas. Y si hay fecundación, es más frecuente que haya un aborto espontáneo, porque el embrión será aneuploide, es decir, tendrá un fallo en los cromosomas que no le deja crecer de forma normal. Y mientras, seguiremos con nuestras reglas hasta la menopausia, pero la infertilidad funcional habrá empezado unos años antes”.
En los próximos años, los mayores avances en reproducción asistida se centrarán en rejuvenecer los ovarios.
Y no es solo un problema de concienciación de los pacientes. En la Clínica Eugin acaban de publicar un estudio en el que preguntan a ginecólogos y personal sanitario: ¿Hasta qué edad puede quedarse embarazada una mujer? Y la respuesta mayoritaria, incluso entre los profesionales, ha sido que hasta los 45 años sin problema. Y esto es lo que trasladan a las mujeres, que suelen llegar a las clínicas de reproducción asistida ya agotadas física y emocionalmente tras muchos intentos. Además, en estos casos, lo más probable es que los expertos les recomienden una fecundación in vitro con óvulos de una donante, algo a lo que en la mayoría de los casos hay reticencia. Por eso gran parte de la investigación que se desarrolla en este campo en la actualidad está destinada a rejuvenecer los óvulos.
‘Lifting’ ovárico
“Ahora sabemos que el útero no envejece, o lo hace en menor medida, pero los ovarios sí. Y por aquí es por donde irán los mayores avances durante los próximos años”, asegura Antonio Pellicer, presidente y fundador del IVI (Instituto Valenciano de Infertilidad), uno de los centros pioneros en España y referencia en todo el mundo en este campo.
Pellicer lidera un grupo de investigación en el Hospital La Fe de Valencia que está usando células madre de la médula ósea para regenerar y estimular el ovario. “Aún no está disponible, pero en un par de años lo estará, porque los resultados son prometedores. Hemos detectado que es recomendable, sobre todo, para mujeres que han sufrido una menopausia precoz o tienen una baja reserva ovárica en torno a los 37 años”, puntualiza. Y sigue: “Otra técnica que estamos ensayando para solucionar el envejecimiento ovárico consiste en cortarlo en piezas y volver a colocarlo en su lugar. Si pensamos en el ovario como en una aceituna, lo que hacemos es sacar la parte blanda, que es donde se encuentran los óvulos, la cortamos en trozos y la volvemos a implantar. Lo hemos hecho ya en once mujeres menopáusicas y en tres casos se han quedado embarazadas de forma espontánea”.
Además, todos los experimentos con médula ósea que han llevado a cabo en los últimos años en el IVI les han puesto tras la pista de las sustancias que producen algunas mujeres que hacen que sus ovarios funcionen mejor que los de otras durante su juventud. Detectarlas y conseguir producirlas de forma artificial también permitiría retrasar ese envejecimiento. “Conseguir desarrollar una pastilla que tomándotela aumente tu reserva ovárica es nuestro sueño. Lo que se está haciendo en la actualidad está en fase experimental, pero seguro que se avanzará en los próximos años”, añade Pellicer.
Por último, también se está trabajando en acabar con la hormonación para estimular la ovulación, que es una parte bastante agresiva de los tratamientos de fertilidad actuales. “Tenemos identificada una proteína que creemos que es la que moviliza a los ovarios para provocar la ovulación. Si esto llega a buen puerto, es posible que acabemos con la estimulación ovárica”, asegura.
Es complicado decidir cuándo es viable un gameto producido in vitro. Con los ratones es fácil, porque se pueden hacer pruebas sin saber qué va a salir, pero con el ser humano no se puede hacer eso.
Un avance que a su vez acabaría con los partos múltiples derivados de los tratamientos de fertilidad. “De hecho, en el futuro, podremos seleccionar el embrión que sabemos que será capaz de implantarse estudiando tanto al embrión como a la madre. Hemos asumido que el útero está siempre preparado, pero no es así: el endometrio tiene un momento en el que está más receptivo y no siempre es el mismo. Así, sabiendo cuándo es el momento idóneo y qué embrión tiene más posibilidades de prosperar, acabaremos con la necesidad de implantar varios, que es la razón por la que se tienen embarazos múltiples”, termina Pellicer. Otro campo esperanzador es el que se ha abierto para quienes padecen o son portadores de una enfermedad genética y por tanto hereditaria.
Madre no hay más que dos
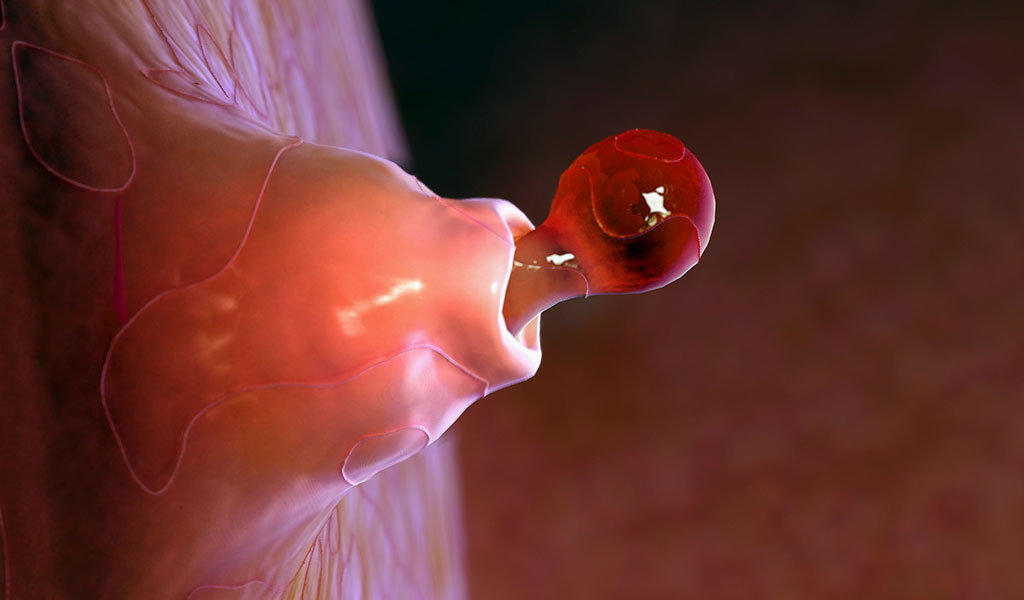
El pasado 27 de septiembre saltaba la noticia: “Nace el primer bebé fruto de la técnica de tres padres”. Es un varón, ya tiene nueve meses y es el primero nacido como resultado de una nueva técnica, que incorpora ADN de tres personas en el mismo ovocito. Esta controvertida técnica (explicada en el recuadro superior), está pensada para casos en los que los padres son portadores de mutaciones raras que les impiden tener hijos sanos. Pero todavía no está aprobada en la mayoría de los países. “En España la ley no la prohíbe expresamente, aunque habría que pedir permiso a la Comisión Nacional de Reproducción Humana Asistida para realizarla”, asegura la doctora Vassena. En el caso del primer niño nacido con esta técnica, la madre era portadora del Síndrome de Leigh, una enfermedad rara que afecta al desarrollo del sistema nervioso desde la concepción y que le había provocado un largo historial de abortos y dos hijos nacidos que murieron a los pocos meses. Los genes que determinan esta enfermedad residen en el ADN mitocondrial, que es el que provee de energía a nuestras células y transporta 37 genes que pasan de la madre al niño (el ADN mitocondrial de los espermatozoides nunca llega a traspasar el óvulo, se queda en la cola). Así que la pareja pidió ayuda a John Zhang y su equipo del New Hope Fertility Center de Nueva York, que ya habían practicado esta técnica previamente aunque sin éxito, como su última oportunidad de tener un niño sano. En este caso todo salió bien y nueve meses más tarde nació un bebé sano, aunque todavía no se sabe cuál será su desarrollo futuro.
En otros casos en los que la enfermedad que se trata de evitar está en la carga genética de los progenitores, ya se utiliza la denominada técnica de análisis preimplantacional. Se generan varios embriones con la carga genética de ambos progenitores y se selecciona aquel que está libre de la enfermedad que portan los padres para implantarlo en el útero de la madre. “Hemos avanzado mucho en el diagnóstico monogénico (las enfermedades que dependen de un solo gen), pero cuando entran en juego más genes es mucho más difícil. En estos casos más complejos pronto entrará en juego el CRISPR, el conocido como “corta y pega” genético. Hasta ahora, nosotros interveníamos eliminando el gen que producía la enfermedad. Pero cuando se trata de una enfermedad en la que intervienen varios genes o el ambiente, con esta técnica podremos reparar el ADN dañado de un embrión y convertirlo en sano”, dice Pellicer.
Otra tendencia cada vez más en auge es la de la procreación entre individuos del mismo sexo. Ahora en estos casos se recurre a la subrogación, utilizando el ADN de uno de los miembros de la pareja y el material de un donante. Pero los avances en el uso de células madre podrían cambiar esto también.
Una de las líneas de investigación en este campo es la creación de óvulos y espermatozoides a partir de células madre. “Esta transformación se ha hecho ya, con relativo éxito (un 20 %), en animales de laboratorio. Se trata de convertir una célula IPS (pluripotente inducida) de cualquier tejido del cuerpo en inmadura y después en una reproductiva. Hasta el momento solo se había conseguido tras implantarla en el órgano reproductor correspondiente pero, en los últimos meses, un equipo liderado por Katsuhiko Hayashi, de la Universidad de Kyushu, en Japón, ha conseguido crear óvulos desde cero en un laboratorio. Y, según los responsables del experimento, el resultado fueron embarazos exitosos en algunos roedores, que tuvieron crías sanas. Sin embargo, la aplicación de estas técnicas al ser humano aún está por verse”, explica Pellicer.
De hecho, por ahora, este tipo de investigaciones se están desarrollando más para conocer el proceso de formación de las células que con fines reproductivos. Porque, como explica Vassena: “Es muy complicado decidir cuándo es viable un gameto producido in vitro. Con los ratones es muy fácil, porque puedes probar sin saber qué va a salir. Pero no se puede hacer lo mismo con un ser humano. Por eso creo que tendremos gametos de animales producidos in vitro en unos cinco años, pero en cuanto a usar la técnica en la reproducción humana, estamos todavía en el campo de la ciencia ficción”.
Desde luego, llegue cuando llegue, esta sería la solución, por ejemplo, para parejas del mismo sexo que quisieran tener un hijo con la carga genética de ambos, aunque en el caso de los hombres después
seguirían necesitando un útero de alquiler para seguir con la gestación. Sin embargo parece que existe una posibilidad, todavía remota, de la fabricación de úteros artificiales. “En el futuro, la mujer no tendrá por qué llevar un embrión en su cuerpo. Este se podrá gestar en un útero artificial, que actuará como una incubadora evolucionada”, asegura la bióloga y periodista inglesa Aarathi Prasad en su libro Como una virgen. Cómo la ciencia está rediseñando las reglas del sexo.
¿Un útero de repuesto?
Sin embargo, Antonio Pellicer no lo tiene tan claro: “Yo creo que crear un útero funcional artificial es muy complicado, al menos por el momento. Los órganos de este tipo que estamos viendo en los últimos años tienen muy poca vascularización, como la retina, parte de la vejiga en mujeres que nacen sin ella, etc. Pero un útero es un órgano mucho más complejo, con una gran cantidad de vasos sanguíneos, conductos que van directamente a la madre. Creo que por el momento esto es una vía muerta”, asegura Pellicer.
De hecho, según explica Vassena: “Se han hecho experimentos para estudiar el desarrollo temprano, siempre en modelos animales, manteniendo un embrión fuera del útero, pero no se ha llegado nunca más allá de unos pocos días por la complejidad que poseen la placenta y los intercambios de todo tipo del feto con la madre. Además, es un proceso que todavía no conocemos bien, con lo que reproducirlo in vitro es impensable y no hay ninguna investigación seria y fundamentada que esté en camino de conseguirlo”. Sin embargo, precisamente un equipo del IVI liderado por Carlos Simón anunciaba en 2015 el hallazgo de la población de células que crean el endometrio, la parte del útero que se prepara para recibir al embrión. Y, sabiendo cómo funciona, el equipo de Simón lo ha repoblado con células madre en mujeres con síndrome de Asherman, que no podían quedarse embarazadas por no tenerlo.
Además, en los últimos años hemos asistido al nacimiento del primer bebé albergado en un útero trasplantado. Una cirugía que también se consideraba lejana, precisamente, por la complejidad del órgano. Ahora, aunque está lejos de ser rutinaria, tampoco está exenta de polémica. “Está todavía en un grado experimental. Hay unos diez embarazos reales tras un trasplante de útero y solo tres niños nacidos. Además hay un gran debate sobre quién debe ser el receptor y quién el donante. ¿Es mejor tomar el órgano de un familiar, normalmente la madre, o de un fallecido? También se plantea si después tiene que dejarse o es mejor quitarlo, una vez que se ha tenido un bebé. Porque mientras está ahí, la receptora está sujeta a la medicación para evitar el rechazo, innecesaria si ya no lo va a usar. Estamos todavía entendiéndolo. Pero está claro que el trasplante de útero es factible y lo será más en el futuro”, explica Vassena. ¿Y qué hay del parto y el embarazo naturales?
Hijos sin sexo
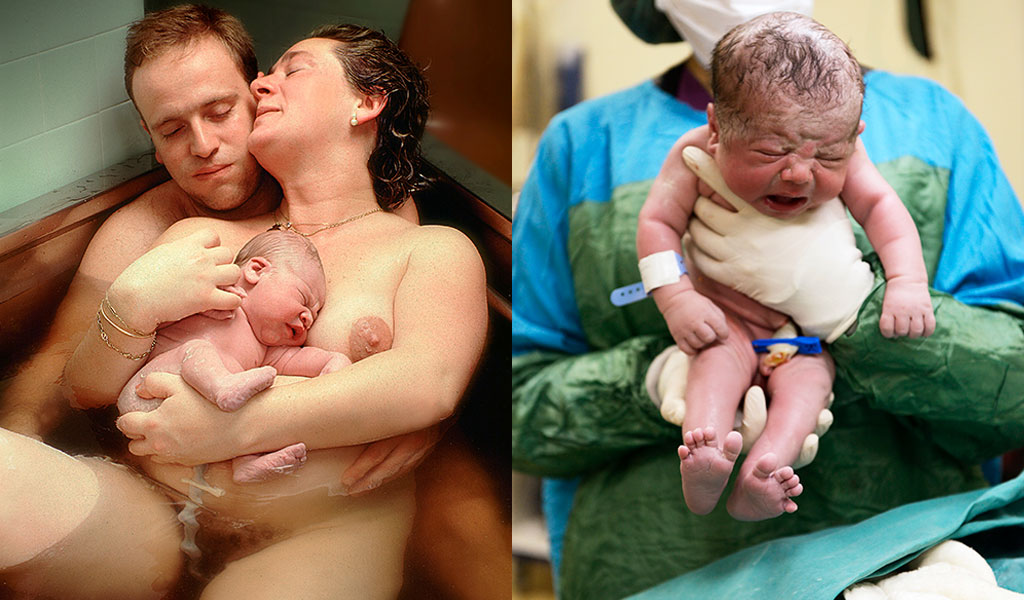
Mireia Cruceyra de la unidad de partos de alto riesgo del Hospital Universitario Quirón Salud de Madrid asegura: “Lo que vemos en la práctica de las maternidades hoy en día es que cada vez las embarazadas son más mayores y hay más partos múltiples. Se han multiplicado la diabetes gestacional, la hipertensión, la preeclampsia y el parto pretérmino por insuficiencia placentaria (la placenta más vieja funciona peor y limita el crecimiento del bebé). En definitiva, una serie de patologías que afectan a la madre y al feto, por lo que es fácil prevenir un futuro con más consultas de alto riesgo y más neonatos con problemas. En ecografía sí se ha avanzado mucho, cada vez tenemos más vigilados a los fetos y estamos detectando signos antes impensables. Con la técnica doppler, por ejemplo, controlamos cómo llega la sangre al feto y el oxígeno a los órganos importantes, como el cerebro. Y gracias a la ecografía 4D tenemos más información sobre cómo funciona el sistema nervioso central”.
Sin embargo los partos siguen igual desde hace veinte años y no tiene pinta de que vayan a cambiar gran cosa. “Al fin y al cabo, se trata de algo que funciona de forma natural. Simplemente, a medio plazo se programarán más partos y habrá más cesáreas. Eso sí, estas son cada vez más humanizadas, se deja pasar al padre y hacer el piel con piel con el bebé. Pero la cirugía en sí es la misma y no parece que vaya a haber cambios. Además, cada vez las mujeres piden más la epidural, por lo que la idea de adoptar posturas novedosas (en cuclillas, de lado, etc…) se reduce mucho”, termina Cruceyra. Por último, hay quien asegura que a largo plazo renunciaremos a tener hijos de forma natural, a engendrarlos y gestarlos en nuestro interior. El director del Centro de Derecho y Biociencia de la Universidad de Stanford, Henry Greely, ha publicado recientemente un libro llamado El final del sexo y el futuro de la reproducción humana, en el que así lo vaticina: “En 20 años ya no se necesitará el sexo para procrear e incluso su uso estará estigmatizado”. Según él, dentro de entre 20 y 40 años, cuando una pareja decida tener un hijo, seguramente a partir de los 40 años, el hombre donará esperma y la mujer un trocito de su piel, con cuyas células madre se crearán óvulos. Después, los embriones resultantes se dividirán en diferentes categorías que permitirán a los padres elegir el que más les convenga. Se etiquetarán según las enfermedades que podrían desarrollar en el futuro; según sus características físicas (como el color del pelo o la complexión) y hasta habrá un apartado sobre el porcentaje de posibilidades de que el futuro vástago en potencia sea más o menos inteligente. Por eso, tener hijos de forma natural será tachado de irresponsable, ya que estaríamos exponiendo a nuestra descendencia a sufrir enfermedades o problemas congénitos “evitables”,